martes, 28 de octubre de 2014
domingo, 26 de octubre de 2014
ELEMENTOS Y COMPUESTOS:
Hidróxidos: son un grupo de compuestos químicos formados por un metal, u otro catión, y uno o varios aniones hidroxilos, en lugar de oxígeno como sucede con los óxidos.
Oxoácidos: son compuestos ternarios formados por un óxido no metálico y una molécula de agua (H2O).
Oxosales: es el producto de sustituir alguno, o todos, los hidrógenos de un oxácido por cationes metálicos, por ejemplo K+, o no metálicos, por ejemplo NH4+. Cuando se sustituyen todos los hidrógenos se forma una oxosal neutra y cuando solo se sustituye una parte una sal ácida.1
Oxoácidos: son compuestos ternarios formados por un óxido no metálico y una molécula de agua (H2O).
Oxosales: es el producto de sustituir alguno, o todos, los hidrógenos de un oxácido por cationes metálicos, por ejemplo K+, o no metálicos, por ejemplo NH4+. Cuando se sustituyen todos los hidrógenos se forma una oxosal neutra y cuando solo se sustituye una parte una sal ácida.1
miércoles, 22 de octubre de 2014
Peróxidos: son sustancias que presentan un enlace oxígeno-oxígeno y que contienen el oxígeno en estado de oxidación −1. La fórmula general de los peróxidos es Metal + (O-1)2-2. Generalmente se comportan como sustancias oxidantes.
Hidróxidos: son un grupo de compuestos químicos formados por un metal, u otro catión, y uno o varios aniones hidroxilos, en lugar de oxígeno como sucede con los óxidos.
Hidróxidos: son un grupo de compuestos químicos formados por un metal, u otro catión, y uno o varios aniones hidroxilos, en lugar de oxígeno como sucede con los óxidos.
Elemento químico es un tipo de materia constituida por átomos de la misma clase. En su forma más simple posee un número determinado de protones en su núcleo, haciéndolo pertenecer a una categoría única clasificada con el número atómico, aun cuando este pueda desplegar distintas masas atómicas.
Compuesto: es una sustancia formada por la unión de dos o más elementos de la tabla periódica. Una característica esencial es que tiene una fórmula química.
Óxido: es un compuesto binario que contiene uno o varios átomos de oxígeno (el cual, normalmente, presenta un estado de oxidación -2),[1] y otros elementos. Existe una gran variedad de óxidos,los cuales se presentan en los 3 principales estados de agregación de la materia: sólido, líquido y gaseoso, a temperatura ambiente.
Hidruros: son compuestos binarios formados por átomos de hidrógeno y de otro elemento químico,[1] pudiendo ser este metal o no metal, con excepción de los gases nobles. Existen dos tipos de hidruros: los metálicos y los no metálicos.
Sales binarias: son compuestos que se forman por la unión de un elemento metálico con un elemento no metálico. Su fórmula general es: MiXj donde M es el elemento metálico, i es la valencia del no metal, X es el elemento no metálico y j es la valencia del metal.
Combinaciones no metal- no metal combinaciones de dos no metales, distintos del oxígeno y el hidrógeno.
Compuesto: es una sustancia formada por la unión de dos o más elementos de la tabla periódica. Una característica esencial es que tiene una fórmula química.
Óxido: es un compuesto binario que contiene uno o varios átomos de oxígeno (el cual, normalmente, presenta un estado de oxidación -2),[1] y otros elementos. Existe una gran variedad de óxidos,los cuales se presentan en los 3 principales estados de agregación de la materia: sólido, líquido y gaseoso, a temperatura ambiente.
Hidruros: son compuestos binarios formados por átomos de hidrógeno y de otro elemento químico,[1] pudiendo ser este metal o no metal, con excepción de los gases nobles. Existen dos tipos de hidruros: los metálicos y los no metálicos.
Sales binarias: son compuestos que se forman por la unión de un elemento metálico con un elemento no metálico. Su fórmula general es: MiXj donde M es el elemento metálico, i es la valencia del no metal, X es el elemento no metálico y j es la valencia del metal.
Combinaciones no metal- no metal combinaciones de dos no metales, distintos del oxígeno y el hidrógeno.
lunes, 6 de octubre de 2014
número atómico: es el número total de protones que tiene el átomo. Se suele representar con la letra Z. Los átomos de diferentes elementos tienen diferentes números de electrones y protones. Un átomo en su estado natural es neutro y tiene número igual de electrones y protones. Un átomo de sodio Na tiene un número atómico 11, posee 11 electrones y 11 protones. Un átomo de magnesio Mg, tiene número atómico 12, posee 12 electrones y 12 protones, y un átomo de uranio U, que tiene número atómico 92, posee 92 electrones y 92 protones.
domingo, 5 de octubre de 2014
Electrón: una partícula subatómica con una carga eléctrica elemental negativa.12 Un electrón no tiene componentes o subestructura conocidos, en otras palabras, generalmente se define como una partícula elemental.


El neutrón: es una partícula subatómica, un nucleón, sin carga neta, presente en el núcleo atómico de prácticamente todos los átomos, excepto el protio. Aunque se dice que el neutrón no tiene carga, en realidad está compuesto por tres partículas


Un elemento: es un tipo de materia constituida por átomos de la misma clase. En su forma más simple posee un número determinado de protones en su núcleo, haciéndolo pertenecer a una categoría única clasificada con el número atómico, aun cuando este pueda desplegar distintas masas atómicas. Es un átomo con características físicas únicas, aquella sustancia que no puede ser descompuesta mediante una reacción química, en otras más simples.
protón: es una partícula subatómica con una carga eléctrica elemental positiva 1 (1,6 × 10-19 C), igual en valor absoluto y de signo contrario a la del electrón, y una masa 1836 veces superior a la de un electrón. Experimentalmente, se observa el protón como estable, con un límite inferior en su vida media de unos 1035 años, aunque algunas teorías predicen que el protón puede desintegrarse en otras partículas.
MODELOS ATÓMICOS:
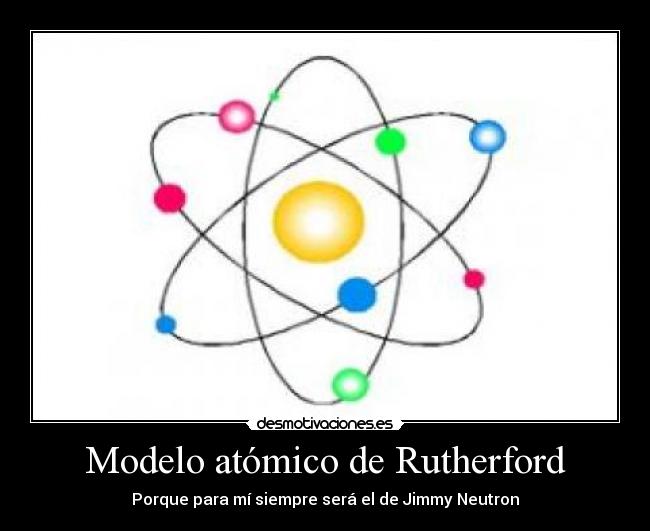
El modelo atómico de Rutherford: es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para explicar los resultados de su "experimento de la lámina de oro", realizado en 1911.
El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo" muy pequeño; que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.
modelo atómico de Thomson: es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, quien descubrió el electrón1 en 1898, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, como un pudin de pasas.2 Postulaba que los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad.
animación interactiva de Thomson
animación interactiva de Thomson
El modelo atómico de Dalton: surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, formulado entre 1803 y 1807 por John Dalton.
El modelo permitió aclarar por primera vez por qué las sustancias químicas reaccionaban en proporciones estequiométricas fijas (Ley de las proporciones constantes), y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros (Ley de las proporciones múltiples).
lunes, 29 de septiembre de 2014
CONCENTRACIONES:
La concentración de una disolución: es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolvente, donde el soluto es la sustancia que se disuelve, el disolvente la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. A menor proporción de soluto disuelto en el disolvente, menos concentrada está la disolución, y a mayor proporción más concentrada está.
solución:


Calcular el tanto por ciento en peso de una disolución formada al añadir 10 g de sulfato cúpricoa 500 g de agua.
Gramos de soluto: 10Gramos de disolvente: 500Gramos de disolución: 10 + 500 = 510Lo normal es calcular tan solo el tanto por ciento de soluto, aunque el de disolvente sería la diferencia hasta 100.
Calcular el tanto por ciento en volumen de una disolución formada por 200 mL de etanol, 100mL de metanol y 400 mL de agua.
mL de etanol: 200ml de metanol: 100mL de agua: 400mL de disolución: 700Se aplica la siguiente fórmula para calcular los porcentajes
Porcentaje masa-masa (% m/m)
Se define como la masa de soluto (sustancia que se disuelve) por cada 100 unidades de masa de lasolución:

Porcentaje volumen-volumen (% V/V)
Expresa el volumen de soluto por cada cien unidades de volumen de la disolución. Se suele usar para mezclas líquidas o gaseosas, en las que el volumen es un parámetro importante a tener en cuenta. Es decir, el porcentaje que representa el soluto en el volumen total de la disolución. Suele expresarse simplificadamente como «% v/v».
Disponemos de ácido clorhídrico comercial (densidad =
1,2 g/cm3 y riqueza 36 % en peso) y deseamos preparar 500 cm3
de una disolución de ácido clorhídrico 0,1 M. Explica detalladamente cómo lo
harías, indicando los cálculos correspondientes.
Respuesta 1
|
Si queremos
preparar 500 cm3 de disolución 0,1 M de HCl, en primer lugar
precisamos calcular los moles de HCl que habrá que tomar del frasco de ácido
clorhídrico comercial, para diluirlos a continuación en el agua necesaria
hasta completar ese volumen de disolución (500 cm3, o lo que es lo
mismo, 0,5 L).
Para ello recordemos que la molaridad de
una disolución expresa la relación entre los moles de soluto y el volumen de
disolución, es decir:
Y sustituyendo los datos:
ns = 0,1 M · 0,5 L = 0,05 mol
Esa cantidad en moles debemos expresarla
en gramos, para poder trabajar con magnitudes más familiares en el
laboratorio, para ello recurrimos a la expresión 2.1.:
Como esa cantidad de HCl tiene que
obtenerse de una disolución comercial (riqueza 36 %), tendremos que calcular
qué masa de ese reactivo contendrá esos 1,825 g de HCl que precisamos:
Al tratarse de
un líquido, es más práctico calcular, a partir de ese dato, el volumen de
disolución comercial que tendremos que emplear, haciendo uso de la densidad
de la misma:
y sustituyendo los datos: Es decir, con una pipeta tomaremos 4,22 cm3 (4,22 mililitros) de la disolución comercial de ácido clorhídrico. En esos 4,22 cm3, que equivalen a una masa de 5,07 g, se encuentran contenidos 1,825 g de HCl puro, que a su vez se corresponden con 0,05 mol de HCl, nuestro soluto en la disolución que queremos preparar.
Ese volumen que tomamos con la pipeta,
lo trasladaremos a un matraz aforado de 500 cm3. Seguidamente,
iremos añadiendo, muy lentamente, agua destilada hasta enrasar con la línea
del matraz que indica los 500 cm3 exactos.
|
domingo, 28 de septiembre de 2014
MÉTODOS DE SEPARACIÓN:
La destilación: es la operación de separar, mediante vaporización y condensación en los diferentes componentes líquidos, sólidos disueltos en líquidos o gases licuados de una mezcla.
DESTILACIÓN
DESTILACIÓN
La centrifugación: es un método por el cual se pueden separar sólidos de líquidos de diferente densidad mediante una fuerza giratoria.
CENTRIFUGACIÓN
CENTRIFUGACIÓN
En la decantación: se separa un sólido o líquido más denso de otro fluido (líquido o gas) menos denso y que por lo tanto ocupa la parte superior de la mezcla.
DECANTACIÓN
DECANTACIÓN
La cristalización: es un proceso por el cual a partir de un gas, un líquido o una disolución.CRISTALIZACIÓN
martes, 23 de septiembre de 2014
martes, 16 de septiembre de 2014
TRABAJO QUÍMICA
-Definición de química: Ciencia que estudia la composición y las propiedades de la materia y de las transformaciones que esta experimenta sin que se alteren los elementos que la forman.
-Breve historia de la química: La química surge en el siglo XVII a partir de los estudios de alquimia populares entre muchos de los científicos de la época. Se considera que los principios básicos de la química se recogen por primera vez en la obra del científico británico Robert Boyle: The Skeptical Chymist (1661). La química como tal comienza sus andares un siglo más tarde con los trabajos del francés Antoine Lavoisier y sus descubrimientos del oxígeno, la ley de conservación de masa y la refutación de la teoría del flogisto como teoría de la combustión.
-Químico famoso y su biografía:Químico sueco que inventó la dinamita y fundó los premios que llevan su nombre (Estocolmo, 1833 - San Remo, Italia, 1896). Pasó gran parte de su juventud en San Petersburgo (Rusia), donde su padre -que era ingeniero- instaló una fábrica de armamento que quebró en 1859. Regresó a Suecia en 1863, completando allí las investigaciones que había iniciado en el campo de los explosivos: en 1863 consiguió controlar mediante un detonador las explosiones de la nitroglicerina, inventada por el italiano Ascanio Sobrero; en 1865 perfeccionó el sistema con un detonador de mercurio; y en 1867 consiguió la dinamita, un explosivo plástico resultante de absorber la nitroglicerina en un material sólido poroso, con lo que se reducían los riesgos de accidente (las explosiones accidentales de la nitroglicerina, en una de las cuales había muerto su propio hermano Emil, habían despertado fuertes críticas contra Nobel y sus fábricas).


jueves, 11 de septiembre de 2014
Suscribirse a:
Entradas (Atom)